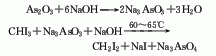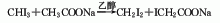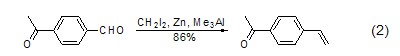化学性质
CAS号:75-11-6
MDL号:MFCD00001079
EINECS号:200-841-5
RTECS号:PA8575000
BRN号:1696892
PubChem号:24849735
物性数据
1.性状:无色澄清至淡黄色液体。
2.熔点(℃):5~6
3.沸点(℃):181(分解)
4.相对密度(水=1):3.32
5.相对蒸气密度(空气=1):9.25
6.燃烧热(kJ/mol):-745.7
7.临界压力(MPa):5.47
8.辛醇/水分配系数:2.3
9.闪点(℃):110
10.溶解性:不溶于水,溶于乙醇、乙醚、苯、氯仿等多数有机溶剂。
11.常温折射率(n20):1.7411
12.常温折射率(n25):1.7380
13.溶度参数(J·cm-3)0.5:24.055
14.van der Waals面积(cm2·mol-1):6.430×109
15.van der Waals体积(cm3·mol-1):50.930
16.黏度(10ºC):3.35mPa。s
17.液相标准声称热(焓)( kJ·mol-1):67.8
18.液相标准热熔(J·mol-1·K-1):135.5
19.气相标准声称热(焓)( kJ·mol-1) :118.7
20.气相标准熵(J·mol-1·K-1) :309.50
21.气相标准生成自由能( kJ·mol-1):101.7
22.气相标准热熔(J·mol-1·K-1):57.73
毒理学数据
1、急性毒性
小孩口服LDLO: 2778 uL/kg
大鼠腹腔LD50: 403mg/kg
小鼠腹腔LD50: 467mg/kg
小鼠皮下LD50: 830mg/kg
2.急性毒性 LD50:403mg/kg(大鼠经口);830mg/kg(大鼠经皮)
3.刺激性 暂无资料
4.致突变性 微生物致突变性:大肠杆菌3mg/皿。
生态学数据
1.生态毒性 暂无资料
2.生物降解性 暂无资料
3.非生物降解性 暂无资料
4.其他有害作用 该物质对环境有危害,应注意对大气的污染。
分子结构数据
1、摩尔折射率:32.62
2、摩尔体积(cm3/mol):82.6
3、等张比容(90.2K):219.9
4、表面张力(dyne/cm):50.0
5、极化率(10-24cm3):12.93
计算化学数据
1、疏水参数计算参考值(XlogP):2.3
2、氢键供体数量:0
3、氢键受体数量:0
4、可旋转化学键数量:0
5、互变异构体数量:
6、拓扑分子极性表面积(TPSA):0
7、重原子数量:3
8、表面电荷:0
9、复杂度:2.8
10、同位素原子数量:0
11、确定原子立构中心数量:0
12、不确定原子立构中心数量:0
13、确定化学键立构中心数量:0
14、不确定化学键立构中心数量:0
15、共价键单元数量:1
性质与稳定性
1.有毒。比二溴甲烷的麻醉性弱。
2.嗅后引起头痛、呼吸困难。参见二溴甲烷。
3.与铜粉存放在一起可以有效地阻止其分解;应注意避光保存;与许多金属 (如Al、Mg、Na等) 和强碱不能共存;有一定的腐蚀性;要在通风橱中进行操作。
4.稳定性 稳定
5.禁配物 强氧化剂、强碱、碱金属
6.避免接触的条件 受热、光照
7.聚合危害 不聚合
8.分解产物 碘化物
储存方法
储存注意事项 储存于阴凉、通风的库房。远离火种、热源。保持容器密封。应与氧化剂、碱类、碱金属、食用化学品分开存放,切忌混储。配备相应品种和数量的消防器材。储区应备有泄漏应急处理设备和合适的收容材料。
安全信息
危险运输编码:UN 2810 6.1/PG 3
危险品标志: 有害
有害
安全标识:S26
危险标识:R22 R36/37/38
合成方法
1.碘仿、亚砷酸钠法 首先用三氧化二砷和液碱反应,配制亚砷酸钠,然后由碘仿、亚砷酸钠溶液混合,在搅拌下加热至60~65℃,再加氢氧化钠一步反应制取二碘甲烷。反应产物经水洗、蒸馏、脱色、结晶、分离和干燥,得成品。
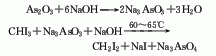
2.碘仿法 经与醋酸钠作用而得,其反应式如下:
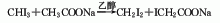
上述反应完成后,经蒸馏得成品。
3.相转移催化合成法 以三乙基苄基氯化铵为催化剂,由二氯甲烷与碘化钠反应而得,其反应式如下:

上下游产品信息
表征图谱
相关文献
用途
1.有机合成原料、化学试剂和药品中间体,可用于制造X光造影剂,测定矿物密度和折射率,以及分离矿物等。
2.二碘甲烷是一种亚甲基转移试剂,可以与不同的金属或者烷基金属反应生成卡宾, 与烯烃发生环丙烷化反应,也可以与羰基发生亚甲基化反应。同时也可以制备ICH2M和I2CHM等亲核试剂,也能够参与自由基偶联反应。
亚甲基化 很多的羰基亚甲基化试剂都使用二碘甲烷作为碳源,可以作为Wittig反应的替代方法;在酮存在下,二碘甲烷和镁汞齐反应,可以得到很高产率的烯烃 (式1)[1]。不同结构的醛和酮都可以发生这个反应。

Lewis酸的存在可以极大地加速该反应的进行,提高反应的选择性和产率。常用的Lewis酸包括三甲基铝、四异丙氧基钛、四氯化钛、二氯二(环戊二烯基)锆等。其中,CH2I2/Zn/ Me3Al和CH2Br2/Zn/TiCl4两组试剂的效果最好。在有酮存在的条件下,醛可以选择性发生亚甲基化反应 (式2)[2]。
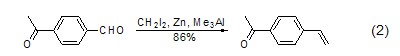
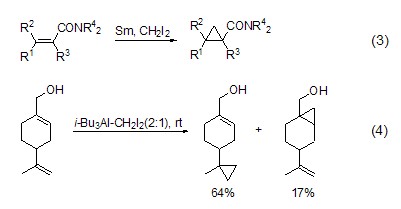
环丙烷化 在有机合成中,二碘甲烷主要用来进行金属参与的环丙烷化反应。最重要的是锌参与的环丙烷化 (Simmons-Smith反应),这是一个被广泛应用并且能够实现多种变化的试剂。锌的来源对反应的成败至关重要,Zn/Cu、二乙基锌等都可以作为Zn的来源进行环丙烷化反应。二碘甲烷和钐汞或者碘化钐可以组合得到很多不同的含钐烯烃环丙烷化试剂,这些试剂都能够和烯丙醇以及烯醇反应。α,β-不饱和酯、α,β-不饱和酰胺也可以在钐催化下与二碘甲烷发生环丙烷化反应 (式3)[3]。含锌试剂和含钐试剂的环丙烷化反应都受到羟基的直接影响[4]。用三烷基铝 (如三异丁基铝) 处理二碘甲烷也会得到相应的环丙烷,这是对锌和钐体系的一个很好的补充,此反应倾向于和独立的烯烃反应,而不是与烯丙醇反应 (式4)。
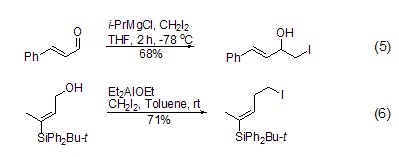
‘ICH2’的亲核加成 由金属钐制备的碘甲基锂[6]可以和醛、酮及烯酮反应,镁试剂也可以用于这一反应 (式5)。而用铝试剂还可以实现碘甲基对烯丙醇羟基的取代,Et3Al、Et2AlCl、Et2AlOEt都可以参与这个反应 (如式6)。
(+)-trans-(2S,3S)-二(二苯基膦)二环[2.2.1]庚-5-烯 |
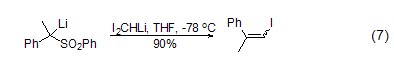
‘I2CH’的亲核加成 CH2I2在碱作用下去质子化后得到I2CHM的衍生物,这些化合物比相应的ICH2M更稳定,能够和许多亲电试剂进行反应。常用的碱有Cy2NLi、NaHMDS、LiHMDS以及LDA等。烯丙基碘就是用I2CHLi来合成的。首先用LiHMDS处理二碘甲烷,然后再加入砜,蒸干水分之后就可以得到烯丙基碘,但是选择性相对较差 (式7)。
自由基加成 在三乙基硼烷存在的情况下,ICH2碎片与α,β-不饱和酮发生加成反应,得到γ-碘酮 (式8)。中间体烯醇化硼既可以被水解,也可以被烷基化。

烷基化反应 二碘甲烷在烷基化方面的应用有限,ClCH2I和ClCH2Br比二碘甲烷更容易发生烷基化反应,但是,二碘甲烷可以用于环烷基化反应中。二胺可以与二碘甲烷反应,缓慢向二胺溶液中加入二碘甲烷溶液可以得到较高的产率 (式9)。在有Pt作为催化剂的反应中,二碘甲烷和硫醇反应可以得到二噻烷。另外,在二碘甲烷与烷基锂共同存在下原位生成碘甲基锂,能够方便快速地将很多羰基化合物转化为环氧化物 (式10)。

3.用于有机合成及混合矿物的分离。



 有害
有害