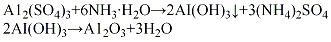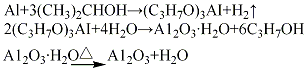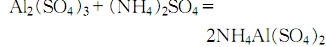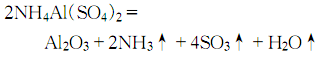化学性质
中文名 氧化铝
外文名 aluminium oxide
化学式 Al₂O₃
分子量 101.96
CAS登录号 1344-28-1

EINECS登录号 215-691-6
熔点 2054ºC
沸点 2980ºC
水溶性 不溶于水,易溶于强碱和强酸
密度 3.5 g/cm³
外观 白色无定形粉状物
安全性描述 S26;S24/25;S16;S7;S36
危险性符号 R36/37/38;R67;R36/38;R11;R36
危险性描述 Xi;F
管制 该品不受限制
晶格常数 a=0.514nm
晶体结构 O2-离子按六方最密堆积排列
晶体类型 离子型
主要成分
氧化铝含有元素铝和氧。若将铝矾土原料经过化学处理,除去硅、铁、钛等的氧化物而制得的产物是纯度很高的氧化铝原料,Al2O3含量一般在99%以上。矿相是由40%~76%的γ- Al2O3和24%~60%的α- Al2O3组成。γ- Al2O3于950~1200℃可转变为α- Al2O3,同时发生显著的体积收缩。
化学性质
和酸反应:
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Al2O3 + 6H+ = 2Al3+ + 3H2O
和熔融的碱反应:
Al2O3 + 2NaOH= 2NaAlO2(偏铝酸钠)+ H2O
和碱溶液反应:
Al2O3+ 2NaOH +3H2O = 2Na[Al(OH)4](四羟基合铝酸钠)
也可以简写为:Al2O3+2OH-=2AlO2-(偏铝酸根离子)+H2O
物理性质
InChI=1/Al.2O/rAlO₂/c2-1-3
分子量:101.96
熔点:2054 ℃
沸点:2980℃
真密度:3.97 g/cm3
松装密度:0.85 g/mL(325目~0)0.9 g/mL(120目~325目)
晶体结构:三方晶系 (hex)
溶解性:常温下不溶于水
导电性:常温状态下不导电
Al₂O₃是离子晶体
热化学属性:
ΔfHθ(l)=1620.57 kJ/mol
ΔfHθ(s)=1675.69 kJ/mol
Sθ(l)= 67.24 J/mol·K(1 bar)
Sθ(s)=50.9 J/mol·K
变体
Al2O3有多种变体,常见的是α,γ型都是白色晶体。
自然界中的刚玉是α型属于六方最密堆积,熔点,硬度高,不溶于酸碱耐腐蚀,绝缘性好。
将氢氧化铝与偏氢氧化铝或铝铵矾在723K共热可得γ型,不溶于水,但吸水性很强,有强吸附能力与催化活性。
β形有离子传导能力,允许Na+通过。
质检指标
水中溶解物,% ≤0.5
硅酸盐合格
碱金属及碱土金属,% ≤0.50
重金属(以Pb计),% ≤0.005
氯化物,% ≤0.01
硫酸盐,% ≤0.05
灼烧失量,% ≤5.0
铁,% ≤0.01
安全信息
安全性
食入 :低危险,易造成老年痴呆,对小孩智力有损害
吸入 :可能造成刺激或肺部伤害
皮肤 :低危险
眼睛 :低危险
在没有特别注明的情况下,使用SI单位和标准气温和气压。
合成方法
(1)其制备方法有酸法,碱法和醇铝法三种。目前国内主要采用碱法,少数厂家采用醇铝法。
酸法将硫酸铝配成6%的水溶液,加入中和槽中,再将液氨配成15%~20%的氨水,按计算量将氨水快速加入,在强烈搅拌下于室温反应40~60 min,至pH值达到8~9左右时,反应基本完成。将生成的沉淀物经压滤、用无离子水洗涤除去杂质离子,洗涤水中一般加少量氨水调节pH值为8~9,以防洗涤过程中氢氧化铝发生胶凝过程而引起物料损失。将洗涤过的沉淀物加入少量33%的硝酸溶液,在强烈搅拌下生成胶状料浆(此过程称为打浆)。再经喷雾干燥,将得到的微球形氢氧化铝挤条成型,在550℃下焙烧活化4h,即脱水形成活性氧化铝。其
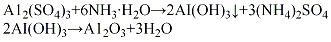
(2)碱法把工业固体烧碱加水配成浓度为600 g/L的烧碱溶液,在50~80℃下加入氢氧化铝后升温至110℃,保温3 h进行反应,将所得溶液用水稀释至含氧化铝为100g/L,静置0.5~1h,经过滤,除去氢氧化铁等不溶性杂质,再将清液和20%硝酸溶液按照一定比例进行中和反应,温度控制在30~50℃下,控制pH 7~7.5,反应10 min 左右以后,再将反应液在常温搅拌下老化2h,经过滤、用无离子水多次洗涤、于110℃烘干、挤条成型、干燥、500℃活化4h,制得活性氧化铝。其

(3)醇铝法将金属铝片加入异丙醇溶液中进行反应,生成异丙醇铝,通过水蒸气鼓泡(入口温度180℃,水解温度175℃),使异丙醇铝水解,生成水合氧化铝,经熟化、过滤、于100℃干燥、500℃脱水活化,制得活性氧化铝。其
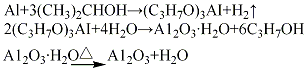
(4)高温快脱法:将氢氧化铝(水合氧化铝)经高温快速脱水、成型、水热处理及干燥后制得成品。
(5)炭化铝胶法:将氢氧化铝和氢氧化钠混合,再经中和、二氧化碳碳化、水洗、压滤、干燥、粉碎、捏合、挤条、干燥、煅烧等过程制得成品。
(6)喷雾干燥法:将氢氧化铝与工业硫酸反应,再经碱液中和、水洗、喷雾干燥、煅烧等过程制得成品。
(7)油柱成型法:将铝锭用工业盐酸溶解,再经油柱成球、水洗、干燥、煅烧等过程制得成品。
制备过程中各种条件,特别是沉淀条件对产品的晶型、表面积、孔结构等影响很大,一般地,低温、低 pH 值下易得到无定形氢氧化铝及拟薄水铝石,高 pH 值易生成三水铝石。拟薄水铝石在 430~500℃下,煅烧得到γ-Al2O3,β三水铝石在 300℃煅烧得到 η-Al2O3。
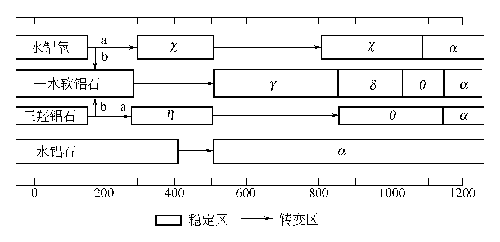
图XIII-14 氢氧化铝的脱水途径
(8)高纯铵明矾热解法以硫酸铝、硫酸铵为原料合成铵明矾(硫酸铝铵),经脱水、热解生成氧化铝,再经转相制得γ-,α-氧化铝。
利用有机铝化合物聚合生成黏稠的聚铝氧烷溶液,将聚铝氧烷溶液进行干式纺丝,得到有机铝化合物纤维,再经煅烧制得氧化铝纤维。
使有机铝化合物聚合,生成黏稠的聚铝氧烷溶液,将其利用普通的干式纺丝法,制成有机铝化合物纤维。再经煅烧制得氧化铝纤维。
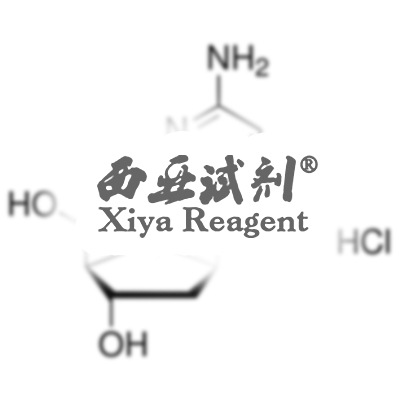
9.制法 方法1.用蒸馏水溶解结晶硫酸铝,然后在不断搅拌下慢慢加入硫酸铵溶液,制得硫酸铝铵:
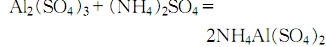
然后加热至100~200℃,除去结晶水后,研成粉末进行高温灼烧,开始在800℃ 灼烧,然后升温至1250~1300℃灼烧4h,冷却后即得氧化铝:
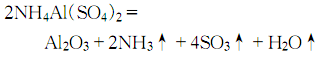
上下游产品信息
表征图谱
相关文献
用途
1.用作催化剂和催化剂载体,是石油炼制和石油化工中主要的催化剂和载体。还用作空气及其他气体的脱湿剂,变压器油和透平油的脱酸剂。
2.用于锻造的加热炉、均热炉等工业用的高温炉。可作密封材料和填充材料。还可作强化用补强纤维,窑炉的炉衬,电子元件(IC板、铁氧体)的煅烧炉等。
3.氧化铝纤维主要用于高温绝热材料和增强复合材料。氧化铝短纤维具有突出的耐高温性能,可与树脂、金属或陶瓷进行复合制备高性能复合材料,制造加热炉、窑炉衬里及电子元件煅烧炉等工业用高温炉。由于其密度小。绝热性好、热容量小,不仅可以减轻炉体质量,而且可以提高控温精度,节能效果显著。氧化铝纤维在高温炉中的节能效果比一般的耐火砖或高温涂料好。将其用于增强金属时,与金属完全不起化学作用,耐腐蚀性好,因此氧化铝纤维是金属的增强纤维。还可用于编织无纺布、编织带、绳索等各种形状的纤维制品。
4.用于制造加热炉、均热炉等工业用高温炉。用作密封材料、填充材料、FRM用增强纤维、窑炉衬里及电子元件(IC基板、铁氧体)煅烧炉等。
5.主要用作化纤纤维填料,也用于化妆品磨面膏的磨面剂、牙膏摩擦剂及冶金和化学品中。
6.分析试剂,有机溶剂的脱水吸附剂,研磨剂,低熔点铅玻璃的配制。
7.氧化铝是色谱中最常用的一种填充材料,有酸性、碱性和中性。是一种能进行催化脱水、消除、加成、缩合、环氧化物开环、氧化和还原反应的试剂,对于均相反应来说反应条件通常更温和、更具有选择性。
加成与缩合反应 无论是亲电反应还是亲核反应,氧化铝都可促进各类杂原子的加成反应。氧化铝也能使羟基和烷氧基发生分子内加成生成相应的烯烃 (式1)[2]。
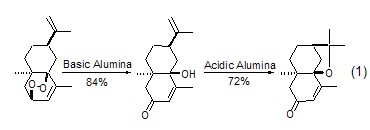
在氧化铝的作用下,醛和不同活性的亚甲基化合物之间的醇醛缩合反应、Michael反应和Wittig反应常在无溶剂、温和的条件下进行。硝基醇醛环化生成2-异唑啉的2-氧化物的反应具有很好的立体选择性 (式2)。
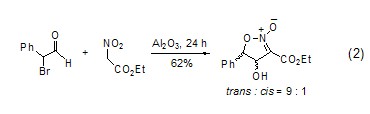
氧化铝有利于Diels-Alder反应、烯烃反应和Carroll重排等受轨道对称性控制的反应。这些反应条件温和且有很高的立体选择性。
在Al2O3的作用下,S可与环氧丙烷更易进行亲核加成反应,而后脱水形成烯 (式3)。
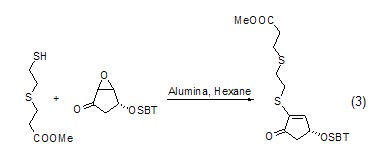
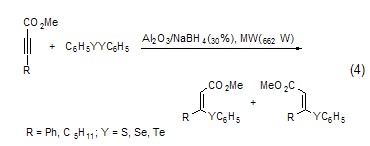
以氧化铝为固相载体微波照射后反应物中的S、Se和Te可以与炔进行亲核加成,产物为α,β-不饱和酯 (式4)。
环氧化反应 在温和的、选择性的条件下,用醇、硫醇、硒醇、胺、羧酸和过氧化物等亲核试剂可以使环氧化物发生开环反应。这种方法可用于顺烯胺的合成 (式5)。

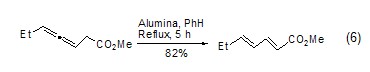
氧化铝可催化许多重排反应。活性的氧化铝使O-磺酰肟发生Beckmann重排生成预期的酰胺,而碱性的氧化铝生成相应的唑啉。在氧化铝作用下,β,γ-不饱和酮可异构化为共轭酮、炔烃异构化成烯烃、烯烃异构化成共轭双烯醇化 (式6)。
氧化铝可促进伯醇乙酸酯水解作用、酰亚胺的脱酰作用、磺酰肟的水解作用和β-酮酸酯和氨基甲酸盐的脱烷氧羰基化作用。